NULLIPARAS/PRIMIPARAS
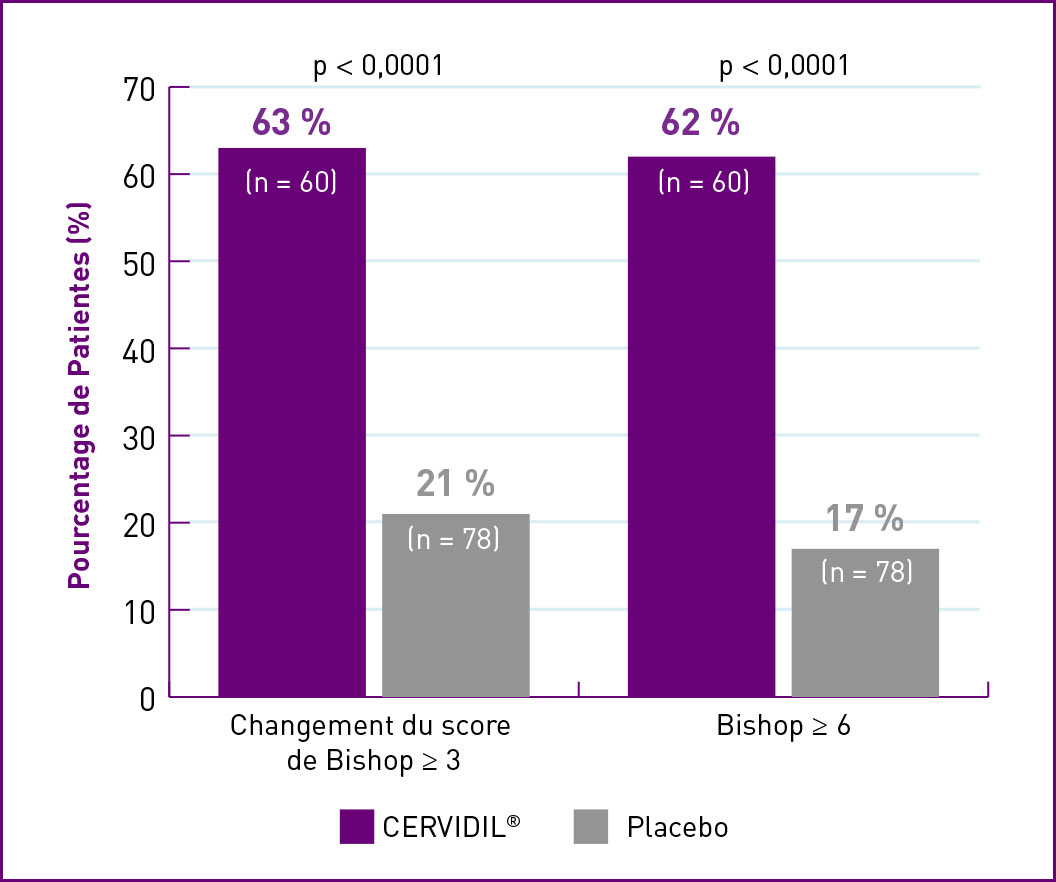
Adapté à partir de Rayburn WF, et coll. 2
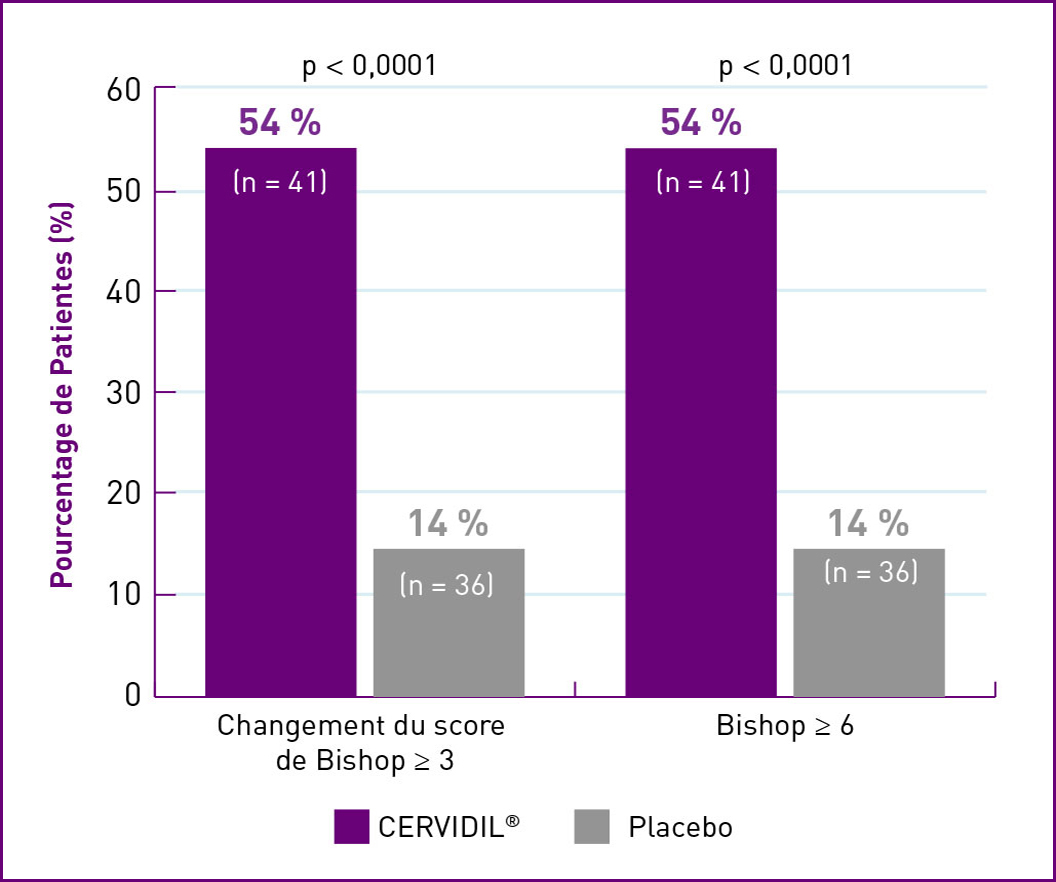
MULTIPARAS
| * | Étude aléatoire à double insu conçue pour évaluer l’efficacité et l’innocuité de CERVIDIL menée auprès de 215 patientes devant subir un déclenchement artificiel du travail. Toutes les patientes présentaient une cotation de Bishop de 4 ou moins et un âge gestationnel de 37 semaines ou plus. Au cours de la période d’observation de 12 heures, les paramètres cliniques comprenaient les changements de la cotation cervicale de Bishop et le début du travail. |
| † | Cotation de Bishop médiane au départ : Patientes nullipares – CERVIDIL = 2,0; Placebo = 2,0. Patientes dont la cote a changé de ≥ 3 : group CERVIDIL : 63 % (n = 60); groupe placebo : 21 % (n = 78). Cotation ≥ 6 : group CERVIDIL : 62 % (n = 60); groupe placebo : 17 % (n = 78). Patientes multipares – CERVIDIL = 3,0 et placebo = 3,0. Patientes dont la cote a changé de ≥ 3 : group CERVIDIL : 54 % (n = 41); groupe placebo : 14 % (n = 36). Cotation ≥ 6 : group CERVIDIL : 54 % (n = 41); groupe placebo : 14 % (n = 36), (p < 0,0001 pour tous les groups de comparison). |
| ‡ | L’effet mesurable a été défini comme une augmentation de la cotation de Bishop de 3 points ou plus par rapport aux données de référence ou une cotation absolue de 6 ou plus. |
| § | La réussite du traitement a été définie comme un changement de la otation de Bishop après 12 heures (l’échec du traitement a été défini comme l’absence de changement de la cotation de Bishop après 12 heures). |
L’HYPERSTIMULATION A ÉTÉ NEUTRALISÉE DANS LES 2 À 13 MINUTES SUIVANT LE RETRAIT DE CERVIDIL DANS LE CADRE D’UN ESSAI CLINIQUE1
PROFIL D’INNOCUITÉ ÉTABLI
CERVIDIL EST BIEN GÉNÉRALEMENT TOLÉRÉ1
- Fièvre liée au médicament, nausées, vomissements, diarrhée et douleur abdominale : signalés chez < 1 % des patientes prenant CERVIDIL
- Étude contrôlée avec système de retrait. Total des événements indésirables liés au médicament p/r au placebo (groupe du traitement actif : n = 102, placebo : n = 104; Hyperstimulation utérine avec détresse fœtale : 2,9 % p/r à 0 %; hyperstimulation utérine sans détresse fœtale : 2,0 % p/r à 0 %; détresse fœtale sans hyperstimulation utérine : 2,9 % p/r à 1 %
RENSEIGNEMENTS SUR L’INNOCUITÉ DE CERVIDIL
Indications et utilisation clinique :
CERVIDIL (dinoprostone) est indiqué pour : L’initiation et/ou la prolongation de la maturation du col chez les patientes arrivées au terme ou près du
terme de leur grossesse et pour qui il existe une indication médicale ou obstétricale pour le déclenchement du travail.
CERVIDIL n’est pas recommandé pour les patientes gériatriques et pédiatriques.
Contre-indications :
- Lorsqu’on soupçonne une détresse fœtale ou lorsqu’on est certain d’une telle détresse fœtale et que l’accouchement n’est pas imminent
- Chez les patientes présentant un placenta praevia ou des saignements vaginaux inexpliqués pendant le cours de la grossesse actuelle
- Dans les cas où il existe des preuves ou de forts soupçons de disproportion céphalopelvienne
- Chez les patientes pour qui les médicaments ocytociques sont contre-indiqués ou lorsqu’il est possible que la prolongation des contractions utérines soit
préjudiciable au bien-être du fœtus ou à l’intégrité de l’utérus (antécédents de césarienne ou de chirurgie utérine majeure) - Chez les patientes multipares ayant déjà amené 6 grossesses à terme ou plus
- Chez les patientes possédant des antécédents de travail difficile et/ou d’accouchement traumatique
- Chez les patientes présentant une surdistension de l’utérus (grossesse multiple, hydramnios)
- Chez les patientes dont le fœtus se présente anormalement
- Chez les patientes possédant des antécédents d’épilepsie et dont les crises ne sont pas bien contrôlées
- On ne doit pas utiliser CERVIDIL de façon simultanée avec d’autres ocytociques
- On ne doit pas utiliser CERVIDIL lorsque la patiente possède des antécédents d’infection génitale haute ou en est actuellement atteinte, à moins qu’un
traitement adéquat n’ait été entrepris auparavant.
Mises en garde et précautions les plus importantes :
À n’utiliser qu’en milieu hospitalier : CERVIDIL ne doit être administré que par du personnel obstétrical qualifié et dans un milieu hospitalier possédant le matériel approprié à la pratique de l’obstétrique.
Autres mises en garde et précautions pertinentes :
- Retrait avant l’administration d’ocytocine
- Retrait en cas d’hyperstimulation utérine ou si le travail commence, avant l’amniotomie, en cas de détresse fœtale, en cas de signes d’effets indésirables chez la mère ou le fœtus
- Prudence chez les patientes ayant des antécédents d’hypertonie utérine, de glaucome ou d’asthme infantile
- Prudence chez les patientes à risque de présenter une coagulation intravasculaire disséminée
- Évaluation de la proportion céphalopelvienne
- Prudence chez les patientes atteintes d’insuffisance rénale grave et/ou de maladie hépatique grave accompagnée d’aberrations métaboliques
- Non indiqué pour une utilisation pendant les phases précoces ou autres de la grossesse ou pendant l’allaitement
- Suivi : Après l’insertion, la patiente doit rester couchée sur le dos pendant 2 heures pour permettre de détecter tout signe d’hyperstimulation utérine, de modification de la fréquence cardiaque fœtale et de la tension artérielle ou de la fréquence cardiaque de la mère.
Pour de plus amples renseignements :
Veuillez consulter la monographie de produit au www.ferring.ca/fr/produits/santé-reproductive/produits-dobstétrique/ pour obtenir des renseignements importants sur les réactions indésirables, les interactions médicamenteuses et les renseignements posologiques qui n’ont pas été mentionnés dans ce document.
Vous pouvez également obtenir la monographie du produit en nous appelant au 1-866-384-1314.
CERVIDIL VOTRE PESSAIRE POUR LA MATURATION CERVICALE1
- La première et seule insertion vaginale de dinoprostone pour le déclenchement de la maturation cervicale1*
- Libération contrôlée et constante de dinoprostone pendant 12 heures**
- Actif dans une matrice de polymère hydrogel
- Le système de retrait rapide assure un retrait rapide et fiable de l’insertion1‡
- Le ruban de retrait en polyester maillé facilite le retrait
-
* La signification clinique comparative n’a pas été établie ** La signification clinique n’a pas été établie ‡ L’effet mesurable a été défini comme une augmentation de la cotation de Bishop de 3 points ou plus par rapport aux données de référence ou une cotation absolue de 6 ou plus.

L’APPLICATION ADÉQUATE AIDE À OPTIMISER L’ADMINISTRATION DU MÉDICAMENT1†
- Des conditions stériles ne sont pas requises pour l’insertion de CERVIDIL
- Les patientes doivent rester couchées sur le dos pendant les 2 heures qui suivent l’insertion

| 1. | Sortir CERVIDIL du congélateur et ouvrir l’emballage d’aluminium à la déchirure prédéfinie |
| 2. | Sortir le système d’administration vaginale CERVIDIL à l’aide du ruban de retrait |
| 3. | Tenir l’insertion CERVIDIL solidement entre le majeur et l’index |
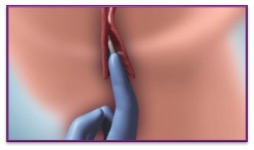
| 4. | Introduire CERVIDIL haut dans le vagin avec une petite quantité de gel aqueux |
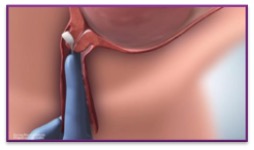
| 5. | Positionner CERVIDIL transversalement derrière le cul-de-sac vaginal postérieur pour s’assurer qu’il ne se déloge pas |
UNE ADMINISTRATION
ADÉQUATE EST ESSENTIELLE
POUR ÉVITER TOUT RISQUE
POTENTIEL, ET DOIT
ÊTRE EFFECTUÉE PAR DU
PERSONNEL QUALIFIÉ
| † | Veuillez consulter la monographie de produit pour obtenir les renseignements complets sur la posologie et l’administration |
RENSEIGNEMENTS SUR L’INNOCUITÉ DE CERVIDIL1
Indications et utilisation clinique :
CERVIDIL (dinoprostone) est indiqué pour : L’initiation et/ou la prolongation de la maturation du col chez les patientes arrivées au terme ou près du
terme de leur grossesse et pour qui il existe une indication médicale ou obstétricale pour le déclenchement du travail.
CERVIDIL n’est pas recommandé pour les patientes gériatriques et pédiatriques.
Contre-indications :
- Lorsqu’on soupçonne une détresse fœtale ou lorsqu’on est certain d’une telle détresse fœtale et que l’accouchement n’est pas imminent
- Chez les patientes présentant un placenta praevia ou des saignements vaginaux inexpliqués pendant le cours de la grossesse actuelle
- Dans les cas où il existe des preuves ou de forts soupçons de disproportion céphalopelvienne
- Chez les patientes pour qui les médicaments ocytociques sont contre-indiqués ou lorsqu’il est possible que la prolongation des contractions utérines soit préjudiciable au bien-être du fœtus ou à l’intégrité de l’utérus (antécédents de césarienne ou de chirurgie utérine majeure)
- Chez les patientes multipares ayant déjà amené 6 grossesses à terme ou plus
- Chez les patientes possédant des antécédents de travail difficile et/ou d’accouchement traumatique
- Chez les patientes présentant une surdistension de l’utérus (grossesse multiple, hydramnios)
- Chez les patientes dont le fœtus se présente anormalement
- Chez les patientes possédant des antécédents d’épilepsie et dont les crises ne sont pas bien contrôlées
- On ne doit pas utiliser CERVIDIL de façon simultanée avec d’autres ocytociques
- On ne doit pas utiliser CERVIDIL lorsque la patiente possède des antécédents d’infection génitale haute ou en est actuellement atteinte, à moins qu’un traitement adéquat n’ait été entrepris auparavant.
Mises en garde et précautions les plus importantes :
À n’utiliser qu’en milieu hospitalier : CERVIDIL ne doit être administré que par du personnel obstétrical qualifié et dans un milieu hospitalier possédant le matériel approprié à la pratique de l’obstétrique.
Autres mises en garde et précautions pertinentes :
- Retrait avant l’administration d’ocytocine
- Retrait en cas d’hyperstimulation utérine ou si le travail commence, avant l’amniotomie, en cas de détresse fœtale, en cas de signes d’effets indésirables chez la mère ou le fœtus
- Prudence chez les patientes ayant des antécédents d’hypertonie utérine, de glaucome ou d’asthme infantile
- Prudence chez les patientes à risque de présenter une coagulation intravasculaire disséminée
- Évaluation de la proportion céphalopelvienne
- Prudence chez les patientes atteintes d’insuffisance rénale grave et/ou de maladie hépatique grave accompagnée d’aberrations métaboliques
- Non indiqué pour une utilisation pendant les phases précoces ou autres de la grossesse ou pendant l’allaitement
- Suivi : Après l’insertion, la patiente doit rester couchée sur le dos pendant 2 heures pour permettre de détecter tout signe d’hyperstimulation utérine, de modification de la fréquence cardiaque fœtale et de la tension artérielle ou de la fréquence cardiaque de la mère.
Pour de plus amples renseignements :
Veuillez consulter la monographie de produit au www.ferring.ca/fr/produits/santé-reproductive/produits-dobstétrique/ pour obtenir des renseignements importants sur les réactions indésirables, les interactions médicamenteuses et les renseignements posologiques qui n’ont pas été mentionnés dans ce document.
Vous pouvez également obtenir la monographie du produit en nous appelant au 1-866-384-1314.
SÉLECTIONNER VOTRE PATIENTE
Les renseignements suivants peuvent vous aider dans la sélection des patientes.
FACTEURS AYANT UNE INCIDENCE DÉMONTRÉE SUR L’INDUCTION DU TRAVAIL3
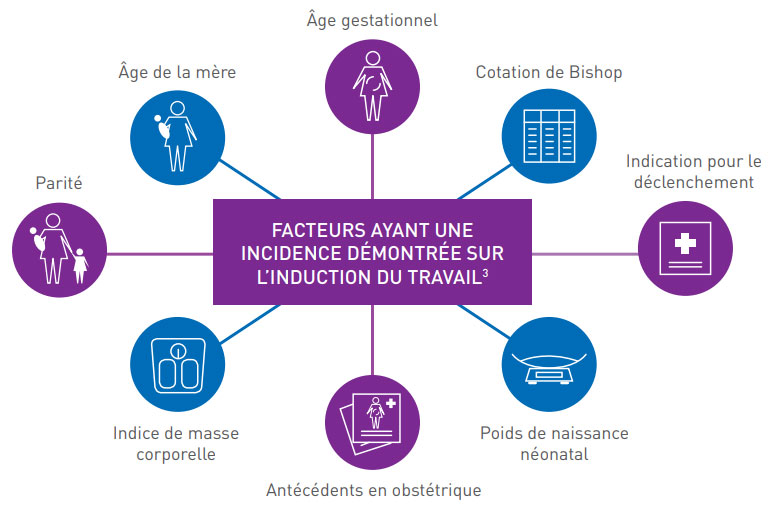
Le traitement et les soins devraient tenir compte des besoins et des préférences individuels de chaque femme.
RENSEIGNEMENTS SUR L’INNOCUITÉ DE CERVIDIL1
Indications et utilisation clinique :
CERVIDIL (dinoprostone) est indiqué pour : L’initiation et/ou la prolongation de la maturation du col chez les patientes arrivées au terme ou près du
terme de leur grossesse et pour qui il existe une indication médicale ou obstétricale pour le déclenchement du travail.
CERVIDIL n’est pas recommandé pour les patientes gériatriques et pédiatriques.
Contre-indications :
- Lorsqu’on soupçonne une détresse fœtale ou lorsqu’on est certain d’une telle détresse fœtale et que l’accouchement n’est pas imminent
- Chez les patientes présentant un placenta praevia ou des saignements vaginaux inexpliqués pendant le cours de la grossesse actuelle
- Dans les cas où il existe des preuves ou de forts soupçons de disproportion céphalopelvienne
- Chez les patientes pour qui les médicaments ocytociques sont contre-indiqués ou lorsqu’il est possible que la prolongation des contractions utérines soit préjudiciable au bien-être du fœtus ou à l’intégrité de l’utérus (antécédents de césarienne ou de chirurgie utérine majeure)
- Chez les patientes multipares ayant déjà amené 6 grossesses à terme ou plus
- Chez les patientes possédant des antécédents de travail difficile et/ou d’accouchement traumatique
- Chez les patientes présentant une surdistension de l’utérus (grossesse multiple, hydramnios)
- Chez les patientes dont le fœtus se présente anormalement
- Chez les patientes possédant des antécédents d’épilepsie et dont les crises ne sont pas bien contrôlées
- On ne doit pas utiliser CERVIDIL de façon simultanée avec d’autres ocytociques
- On ne doit pas utiliser CERVIDIL lorsque la patiente possède des antécédents d’infection génitale haute ou en est actuellement atteinte, à moins qu’un traitement adéquat n’ait été entrepris auparavant.
Mises en garde et précautions les plus importantes :
À n’utiliser qu’en milieu hospitalier : CERVIDIL ne doit être administré que par du personnel obstétrical qualifié et dans un milieu hospitalier possédant le matériel approprié à la pratique de l’obstétrique.
Autres mises en garde et précautions pertinentes :
- Retrait avant l’administration d’ocytocine
- Retrait en cas d’hyperstimulation utérine ou si le travail commence, avant l’amniotomie, en cas de détresse fœtale, en cas de signes d’effets indésirables chez la mère ou le fœtus
- Prudence chez les patientes ayant des antécédents d’hypertonie utérine, de glaucome ou d’asthme infantile
- Prudence chez les patientes à risque de présenter une coagulation intravasculaire disséminée
- Évaluation de la proportion céphalopelvienne
- Prudence chez les patientes atteintes d’insuffisance rénale grave et/ou de maladie hépatique grave accompagnée d’aberrations métaboliques
- Non indiqué pour une utilisation pendant les phases précoces ou autres de la grossesse ou pendant l’allaitement
- Suivi : Après l’insertion, la patiente doit rester couchée sur le dos pendant 2 heures pour permettre de détecter tout signe d’hyperstimulation utérine, de modification de la fréquence cardiaque fœtale et de la tension artérielle ou de la fréquence cardiaque de la mère.
Pour de plus amples renseignements :
Veuillez consulter la monographie de produit au www.ferring.ca/fr/produits/santé-reproductive/produits-dobstétrique/ pour obtenir des renseignements importants sur les réactions indésirables, les interactions médicamenteuses et les renseignements posologiques qui n’ont pas été mentionnés dans ce document.
Vous pouvez également obtenir la monographie du produit en nous appelant au 1-866-384-1314.
CENTRE DE RESSOURCES
LIENS UTILES
Utilisez les informations ci-dessous pour obtenir des ressources pédagogiques professionnelles et patientes
| Alberta Health Services | https://www.albertahealthservices.ca/main/search/Pages/Search.aspx?k=Induction+of+labour+policy |
| BC Perinatal Services | http://www.perinatalservicesbc.ca/Documents/Guidelines-Standards/Maternal/CervicalRipeningInductionLabourGuideline.pdf |
| Canadian Association of Perinatal and Women’s Health Nurses | www.capwhn.ca |
| Canadian Institute of Health Information (CIHI) Giving Birth in Canada | https://www.cihi.ca/fr |
| Precare Gynecological Surgery Guide | https://precare.ca/fr/chirurgie-gynecologique/ |
| Society of Obstetricians and Gynecologists of Canada | www.sogc.org/fr |
| TVASurg Gynecological Surgery videos | https://pie.med.utoronto.ca/TVASurg/all-categories/obstetrics/ |
RENSEIGNEMENTS SUR L’INNOCUITÉ DE CERVIDIL1
Indications et utilisation clinique :
CERVIDIL (dinoprostone) est indiqué pour : L’initiation et/ou la prolongation de la maturation du col chez les patientes arrivées au terme ou près du
terme de leur grossesse et pour qui il existe une indication médicale ou obstétricale pour le déclenchement du travail.
CERVIDIL n’est pas recommandé pour les patientes gériatriques et pédiatriques.
Contre-indications :
- Lorsqu’on soupçonne une détresse fœtale ou lorsqu’on est certain d’une telle détresse fœtale et que l’accouchement n’est pas imminent
- Chez les patientes présentant un placenta praevia ou des saignements vaginaux inexpliqués pendant le cours de la grossesse actuelle
- Dans les cas où il existe des preuves ou de forts soupçons de disproportion céphalopelvienne
- Chez les patientes pour qui les médicaments ocytociques sont contre-indiqués ou lorsqu’il est possible que la prolongation des contractions utérines soit préjudiciable au bien-être du fœtus ou à l’intégrité de l’utérus (antécédents de césarienne ou de chirurgie utérine majeure)
- Chez les patientes multipares ayant déjà amené 6 grossesses à terme ou plus
- Chez les patientes possédant des antécédents de travail difficile et/ou d’accouchement traumatique
- Chez les patientes présentant une surdistension de l’utérus (grossesse multiple, hydramnios)
- Chez les patientes dont le fœtus se présente anormalement
- Chez les patientes possédant des antécédents d’épilepsie et dont les crises ne sont pas bien contrôlées
- On ne doit pas utiliser CERVIDIL de façon simultanée avec d’autres ocytociques
- On ne doit pas utiliser CERVIDIL lorsque la patiente possède des antécédents d’infection génitale haute ou en est actuellement atteinte, à moins qu’un traitement adéquat n’ait été entrepris auparavant.
Mises en garde et précautions les plus importantes :
À n’utiliser qu’en milieu hospitalier : CERVIDIL ne doit être administré que par du personnel obstétrical qualifié et dans un milieu hospitalier possédant le matériel approprié à la pratique de l’obstétrique.
Autres mises en garde et précautions pertinentes :
- Retrait avant l’administration d’ocytocine
- Retrait en cas d’hyperstimulation utérine ou si le travail commence, avant l’amniotomie, en cas de détresse fœtale, en cas de signes d’effets indésirables chez la mère ou le fœtus
- Prudence chez les patientes ayant des antécédents d’hypertonie utérine, de glaucome ou d’asthme infantile
- Prudence chez les patientes à risque de présenter une coagulation intravasculaire disséminée
- Évaluation de la proportion céphalopelvienne
- Prudence chez les patientes atteintes d’insuffisance rénale grave et/ou de maladie hépatique grave accompagnée d’aberrations métaboliques
- Non indiqué pour une utilisation pendant les phases précoces ou autres de la grossesse ou pendant l’allaitement
- Suivi : Après l’insertion, la patiente doit rester couchée sur le dos pendant 2 heures pour permettre de détecter tout signe d’hyperstimulation utérine, de modification de la fréquence cardiaque fœtale et de la tension artérielle ou de la fréquence cardiaque de la mère.
Pour de plus amples renseignements :
Veuillez consulter la monographie de produit au www.ferring.ca/fr/produits/santé-reproductive/produits-dobstétrique/ pour obtenir des renseignements importants sur les réactions indésirables, les interactions médicamenteuses et les renseignements posologiques qui n’ont pas été mentionnés dans ce document.
Vous pouvez également obtenir la monographie du produit en nous appelant au 1-866-384-1314.
Références :
- Monographie de CERVIDIL, Ferring Inc., 29 septembre 2006.
- Rayburn WF et coll., « An intravaginal controlled-release prostaglandin E2 pessary for cervical ripening and initiation of labor at term ». Obstet Gynecol 1992;79:374-379.
- Lignes directrices de la SOGC sur le travail https://www.jogc.com/article/S1701-2163(15)30842-2/pdf


 BALADOS
BALADOS